Skillnad mellan versioner av "Allmänna gaslagen"
Från Täpp-Anders
Anders (Diskussion | bidrag) (Created page with "Ideala gaslagen eller allmänna gaslagen beskriver sambanden mellan tryck, volym, temperatur och substansmängd hos ideala gaser. Ideala gaser är en approximation av hur gase...") |
Anders (Diskussion | bidrag) |
||
| (En mellanliggande version av samma användare visas inte) | |||
| Rad 1: | Rad 1: | ||
| + | [[category:tryck]] | ||
Ideala gaslagen eller allmänna gaslagen beskriver sambanden mellan tryck, volym, temperatur och substansmängd hos ideala gaser. Ideala gaser är en approximation av hur gaser egentligen beter sig och i fallet gas-vätska stämmer de riktigt väl så länge gasens densitet är betydligt lägre än den kondenserade vätskan vilket för de flesta fall gäller. | Ideala gaslagen eller allmänna gaslagen beskriver sambanden mellan tryck, volym, temperatur och substansmängd hos ideala gaser. Ideala gaser är en approximation av hur gaser egentligen beter sig och i fallet gas-vätska stämmer de riktigt väl så länge gasens densitet är betydligt lägre än den kondenserade vätskan vilket för de flesta fall gäller. | ||
| Rad 6: | Rad 7: | ||
Där: | Där: | ||
| − | :p är gasens tryck [N m<sup>-2</sup>] | + | :''p'' är gasens tryck [N m<sup>-2</sup>] |
| − | :V är gasens volym [m<sup>3</sup>] | + | :''V'' är gasens volym [m<sup>3</sup>] |
| − | :n är gasens substansmängd [mol] | + | :''n'' är gasens substansmängd [mol] |
| − | :R är gaskonstanten [8,3145 J mol<sup>-1</sup> K<sup>-1</sup>] | + | :''R'' är gaskonstanten [8,3145 J mol<sup>-1</sup> K<sup>-1</sup>] |
| − | :T är snittemperaturen hos gasen i Kelvin [K] | + | :''T'' är snittemperaturen hos gasen i Kelvin [K] |
Gaslagen kan härledas från kinetiska gasteorin och innebär vissa förutsättningar: | Gaslagen kan härledas från kinetiska gasteorin och innebär vissa förutsättningar: | ||
Nuvarande version från 20 februari 2013 kl. 05.23
Ideala gaslagen eller allmänna gaslagen beskriver sambanden mellan tryck, volym, temperatur och substansmängd hos ideala gaser. Ideala gaser är en approximation av hur gaser egentligen beter sig och i fallet gas-vätska stämmer de riktigt väl så länge gasens densitet är betydligt lägre än den kondenserade vätskan vilket för de flesta fall gäller.
För en ideal gas gäller:
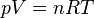
Där:
- p är gasens tryck [N m-2]
- V är gasens volym [m3]
- n är gasens substansmängd [mol]
- R är gaskonstanten [8,3145 J mol-1 K-1]
- T är snittemperaturen hos gasen i Kelvin [K]
Gaslagen kan härledas från kinetiska gasteorin och innebär vissa förutsättningar:
- gasen består av partiklar som kan anses punktformiga
- gasens molekyler befinner sig i snabb rörelse (Browns rörelse)
- molekylerna kolliderar med varandra och med behållarens väggar i fullständigt elastisk stöt så att rörelsemängd och rörelseenergi bevaras
- det inte förekommer någon annnan växelverkan mellan molekylerna och omgivningen
Andra generaliseringar är exempelvis van der Wals lag.