Termodynamik
Innehåll
Huvudsatserna
"Nollte" huvudsatsen
Om två kroppar är i termisk jämvikt med en tredje kropp, då är de även i termisk jämvikt med varandra.
Första huvudsatsen
Lagen om energins bevarande. Energi kan inte skapas eller förstöras, endast omvandlas från ett tillstånd till ett annat.
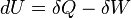
Där:
- dU är förändringen i systemets inre energi
- δQ är den värme som systemet utväxlat med omgivningen
- δW är det arbete som tillförts eller uträttats av systemet
Den till- eller avförda värmen i ett system är lika med den till- eller utförda arbetsmängden i systemet.
Andra huvudsatsen
Värme kan av sig själv ej övergå från en kropp med lägre temperatur till en kropp med högre temperatur.
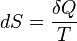
Där:
- dS är entropiförändringen hos ett system
- δQ är den värme som systemet utväxlat med omgivningen
- T är den absoluta temperaturen hos systemet
Detta gäller så länge processen är reversibel.
Tredje huvudsatsen
Entropin för en perfekt kristall närmar sig noll när den absoluta temperaturen närmar sig noll.
De flesta rena ämnen antar en perfekt kristallstruktur vid T=0. Allmänt utgör denna struktur ett ena unikt mikrotillstånd och utifrån Boltzmanns statiska entropidefinition S = kB·ln(W) innebär detta att S = 0 då W = 1.
Helium är ett viktigt undantag mot denna regel då den inte verkar bete sig som en perfekt kristall vid nolltemperatur samt att det är i princip inte möjligt att utforma system helt i avsaknad av värmerörelse i praktiken.